即可将网页分享至朋友圈
近日,生命科学与技术学院刘贻尧教授团队在国际著名期刊《Biomaterials》上发表题为《Multistage-responsive nanovehicle to improve tumor penetration for dual-modality imaging-guided photodynamic-immunotherapy》(多级响应纳米载体增强肿瘤穿透性用于双模态成像引导的光动力免疫联合治疗)的研究论文。该团队的博士生冯易为论文第一作者,电子科技大学为第一作者单位,刘贻尧教授、杨红副教授、重庆大学生物工程学院王贵学教授为该文章的共同通讯作者,这是我校在生物材料与微纳医学研究领域的重要进展。
免疫检查点阻断治疗旨在逆转免疫抑制性肿瘤微环境并促进肿瘤特异性T细胞免疫以发挥抗肿瘤作用。然而,基于PD-1/PD-L1检查点的免疫疗法由于缺乏靶向或无法实现对体内T细胞功能的持续调节而导致其对大多数肿瘤患者的治疗效果不理想。因此,利用纳米材料将免疫治疗与其他形式的治疗结合起来,在增强免疫应答和抗肿瘤治疗的同时,实现药物的有效递送和控制释放是治疗恶性肿瘤最有效的手段之一。基于此,本文开发了一种新型的基于 Fe3O4-Au 内核的免疫调节多功能纳米平台(MB@MSP)用于MRI/μCT双模态成像引导的光动力和PD-1/PD-L1免疫检查点阻断的联合治疗。在该纳米系统中,具有Fe3O4-Au内核的介孔二氧化硅纳米粒可用于核磁共振(MR)和微计算断层扫描(μCT)成像,实现对实体瘤的无创性诊断以及对药物输送过程的实时动态监测。具有基质金属蛋白酶-2(MMP-2)响应的抗PD-L1多肽(PDPPA-1)通过共价连接到介孔硅表面封堵介孔防止孔内的光敏剂亚甲蓝(MB)在血液循环过程中发生泄露。由于肿瘤基质中高表达的MMP-2对PDPPA-1肽的裂解,以及肿瘤细胞内高浓度的谷胱甘肽对二硫键的进一步破坏,最终导致MB@MSP尺寸减小和电荷反转。这些转变促进了纳米载体对肿瘤的渗透和吸收。释放的PDPPA-1肽可以阻断免疫检查点,创造有利于激活细胞毒性T淋巴细胞的环境,并增强光动力疗法引起的肿瘤细胞免疫原性死亡和肿瘤细胞凋亡,从而显著改善治疗效果。体内外实验表明,MB@MSP不仅能诱导肿瘤细胞凋亡,而且能调节免疫抑制性的肿瘤微环境,通过可视化的联合治疗作用消除荷瘤小鼠的原发肿瘤,并进一步抑制肿瘤的转移和远端肿瘤的发展。本工作表明MB@MSP在癌症可视化治疗和癌症联合治疗方面具有巨大的应用潜力。该研究得到国家自然科学基金、四川省科技计划、以及国家生物产业基地(重庆)公共实验中心技术支持。
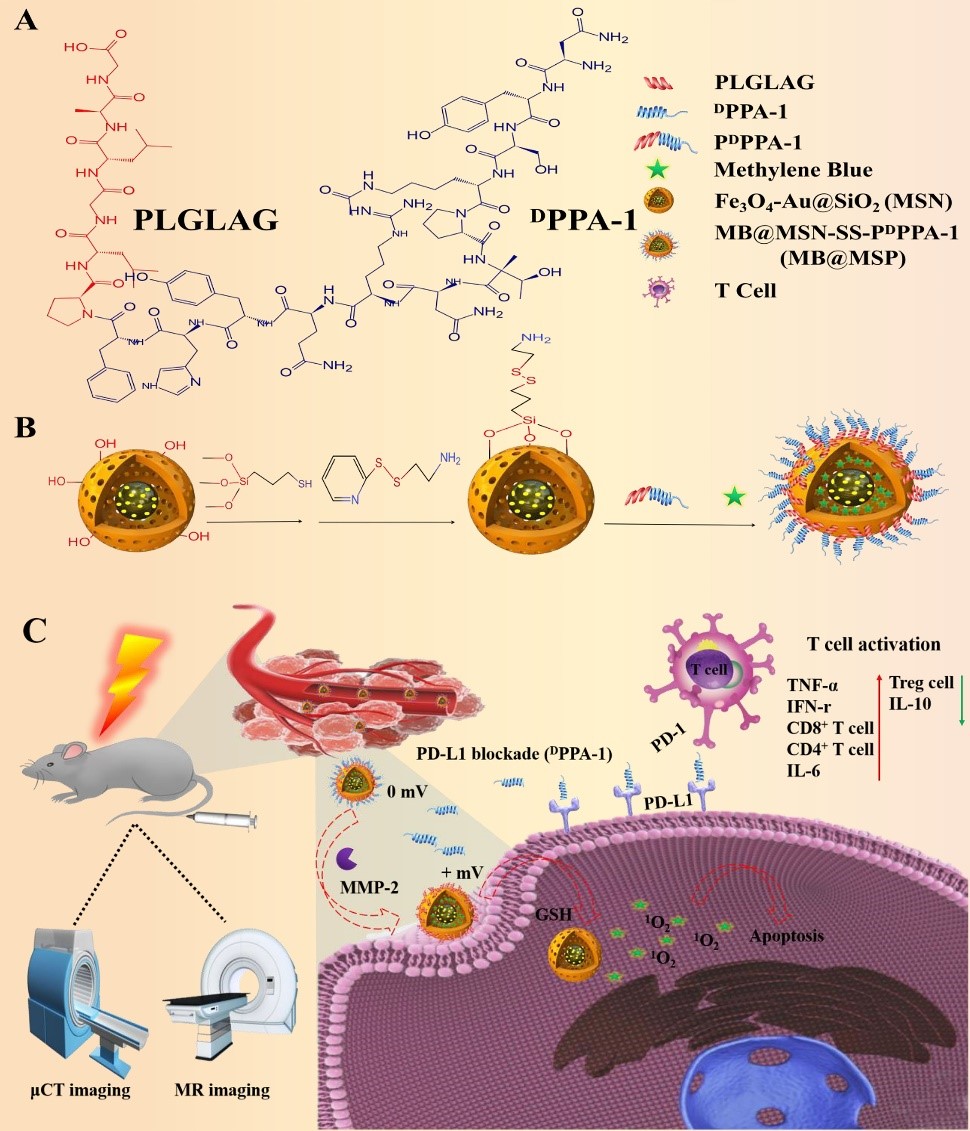
图注:A) 多肽的结构;B) MB@MSP纳米颗粒的合成步骤示意图;C)MB@MSP用于光动力联合免疫抗肿瘤治疗的示意图
《Biomaterials》是Elsevier旗下的生物材料和生物医学领域国际Top期刊之一,在国际生物材料领域排名第一,2020年影响因子为12.479。该杂志涵盖生物材料的科学及临床应用领域,研究生物材料的临床实践及此过程中的重大问题,推动生物材料的设计及生物医学应用。期刊收录了该领域最前沿的优秀论文,属于中科院JCR期刊分区一区。
刘贻尧带领的生物力学与微纳医学工程研究团队主要来致力于肿瘤细胞生物力学、微纳医学、细胞-材料交互作用与调控机制等交叉学科的研究,已经取得了丰富的研究成果,该团队在Nature Communications、Biotechnology Advances、Biomaterials等期刊上发表论文100余篇,近年来团队先后主持和完成了国家自然科学基金及省部级项目20余项。
论文链接: https://www.sciencedirect.com/science/article/pii/S014296122100346X
编辑:卜一珂 / 审核:陈伟 / 发布:陈伟


